В четырех пронумерованных пробирках находятся растворы неорганических веществ. О них известно следующее:
— вещества из пробирок № 1 и № 4 нейтрализуют друг друга;
— при добавлении к содержимому пробирки № 2 вещества из пробирки № 4 выделяется газ (н. у.) с резким запахом, применяемый в медицине;
— вещества из пробирок № 2 и № 3 реагируют между собой с образованием белого осадка.
Установите соответствие между названием неорганического вещества и номером пробирки, в которой находится раствор данного вещества.
НАЗВАНИЕ ВЕЩЕСТВА
А) сульфат аммония
Б) нитрат бария
В) соляная кислота
Г) гидроксид натрия
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А1Б4B2ГЗ.
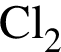
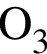
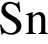
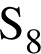
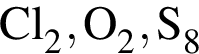 являются молекулами, а не символами. Символы химических элементов представлены в таблице Менделеева.
являются молекулами, а не символами. Символы химических элементов представлены в таблице Менделеева.
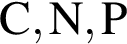
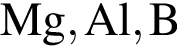
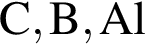
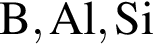
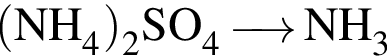 можно использовать вещество, формула которого:
можно использовать вещество, формула которого: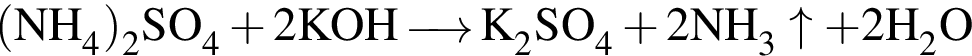 .
.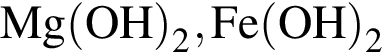
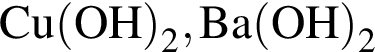
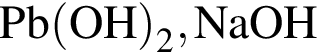
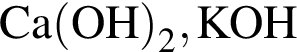
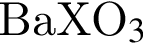 образуется при взаимодействии водного раствора гидроксида бария с оксидом, формула которого:
образуется при взаимодействии водного раствора гидроксида бария с оксидом, формула которого: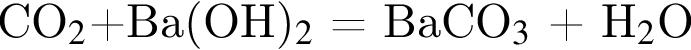
 массовая доля кислорода составляет:
массовая доля кислорода составляет:  Массовая доля цинка больше массовой доли кислорода в
Массовая доля цинка больше массовой доли кислорода в 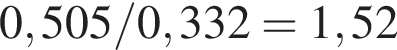 раз.
раз. а у озона 2.1
а у озона 2.1  Выражение в задании, что плотность кислорода выше, чем у озона, неверное.
Выражение в задании, что плотность кислорода выше, чем у озона, неверное.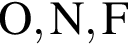 :
: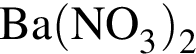
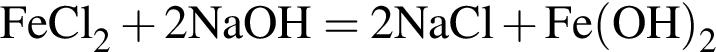 ↓
↓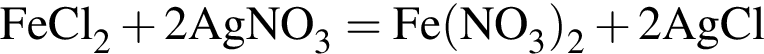 ↓
↓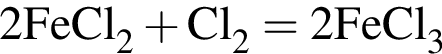
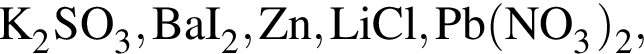 которые реагируют (20 °C) с раствором сульфата натрия, равно:
которые реагируют (20 °C) с раствором сульфата натрия, равно: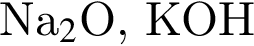
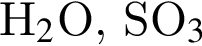
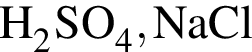
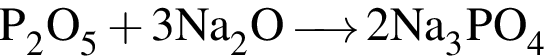 .
.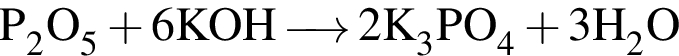 .
.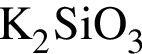
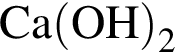
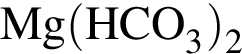
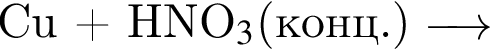
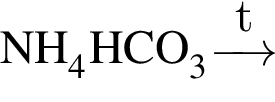
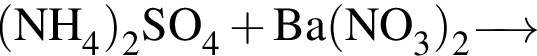

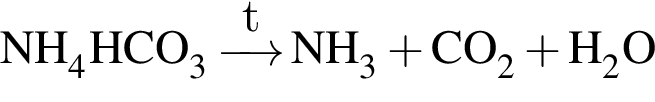
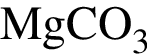
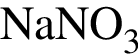
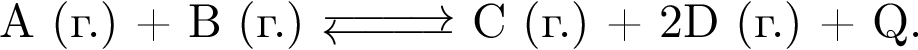
 :
: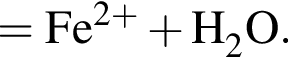 Уравнению соответствует реакция между:
Уравнению соответствует реакция между: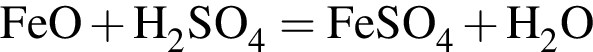
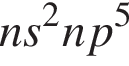 — электронная конфигурация внешнего слоя атомов элементов VIIА-группы в основном состоянии
— электронная конфигурация внешнего слоя атомов элементов VIIА-группы в основном состоянии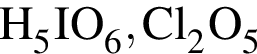 , находятся в высшей степени окисления
, находятся в высшей степени окисления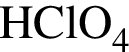 ,
, 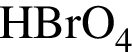 и
и 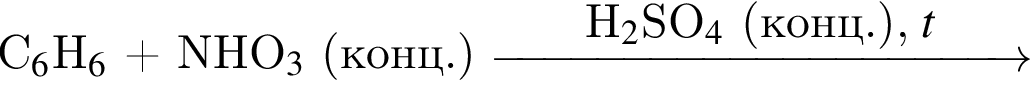 укажите верные утверждения:
укажите верные утверждения: 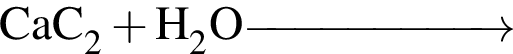
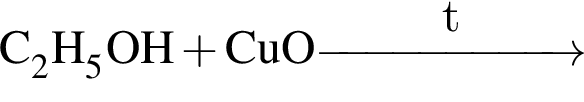
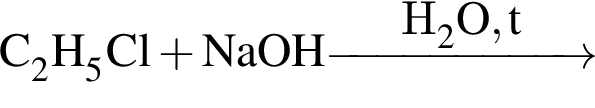
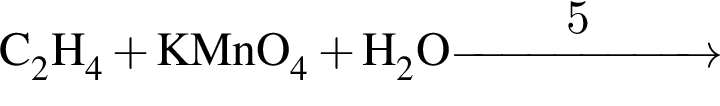
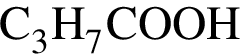 , а стеариновая -
, а стеариновая - 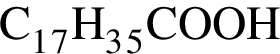 . Ответ 4.
. Ответ 4.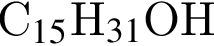
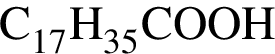
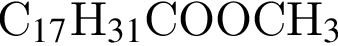
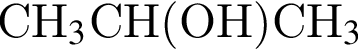
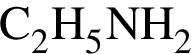 (2 моль) и
(2 моль) и 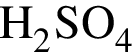 (1 моль) образуется (20 °C):
(1 моль) образуется (20 °C):
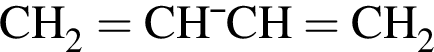
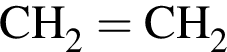
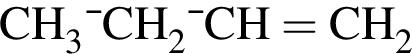
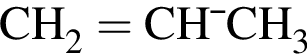
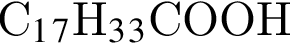 . Очевидно, что у нее 18 атомов углерода.
. Очевидно, что у нее 18 атомов углерода.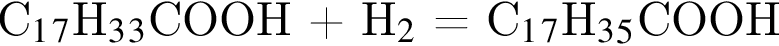 Формула пальмитиновой кислоты -
Формула пальмитиновой кислоты - 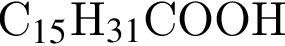 .
.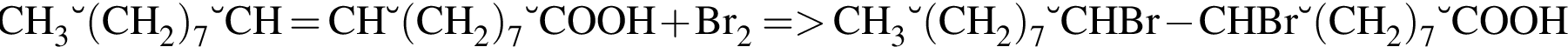 , что соответствует
, что соответствует 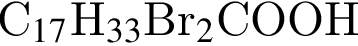
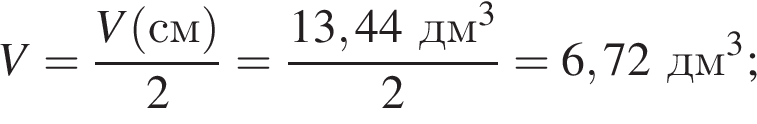

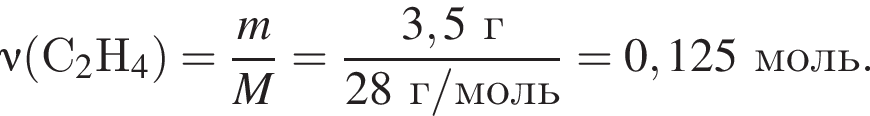
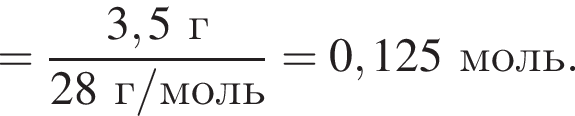
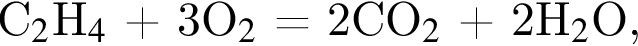
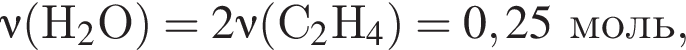

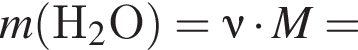
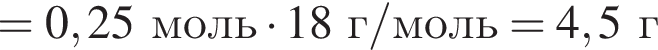
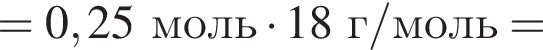
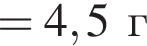
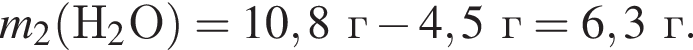
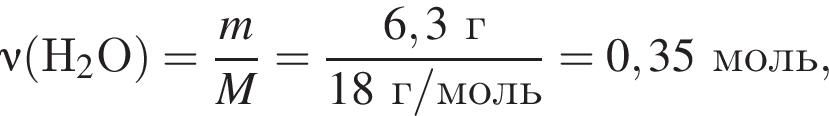
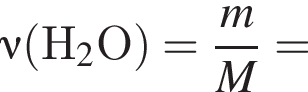
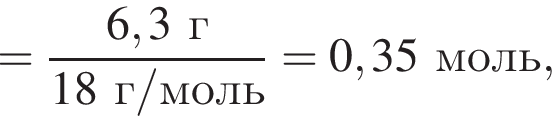

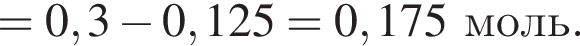
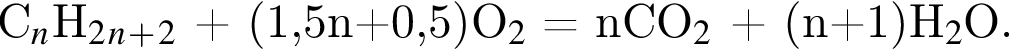
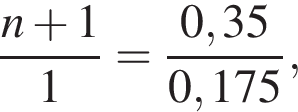 откуда n = 1, следовательно, это метан.
откуда n = 1, следовательно, это метан.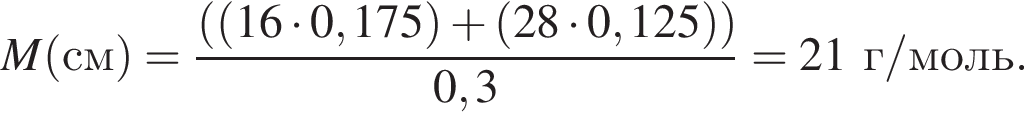
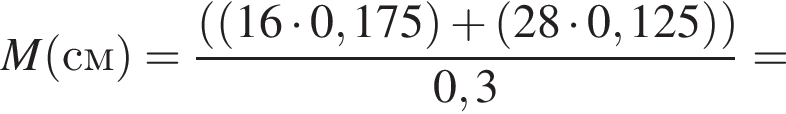
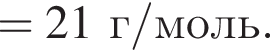

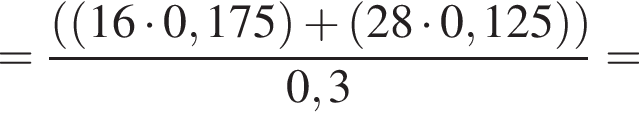
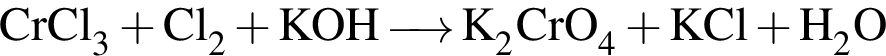
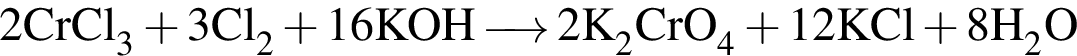
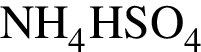 →
→ 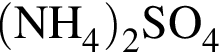
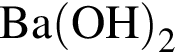
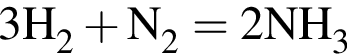
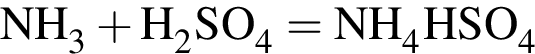
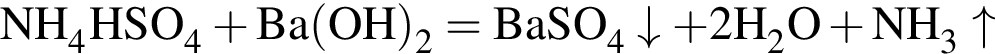
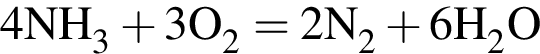
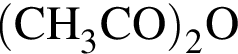 легко взаимодействует с водой, образуя уксусную кислоту:
легко взаимодействует с водой, образуя уксусную кислоту: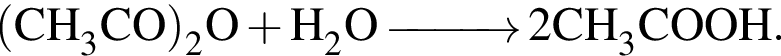
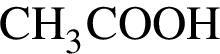 82% (
82% (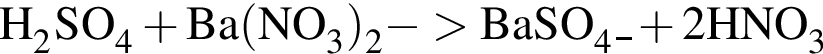
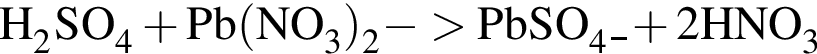
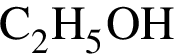
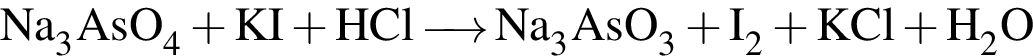
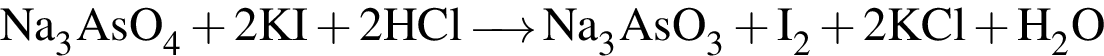
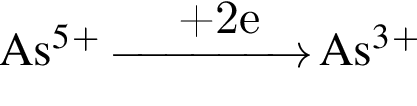
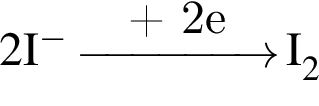
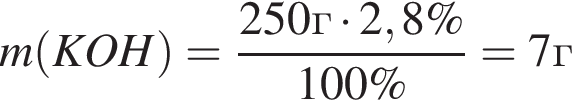
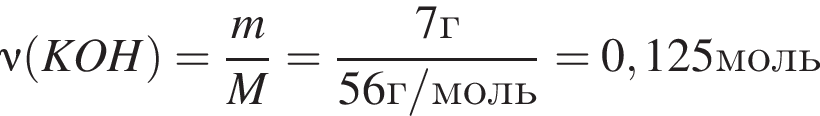
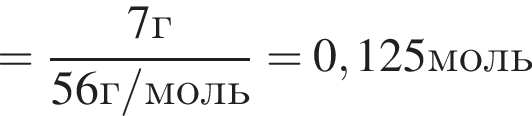
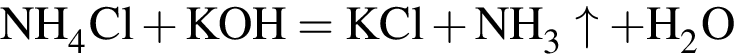 , оставшийся
, оставшийся 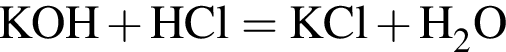
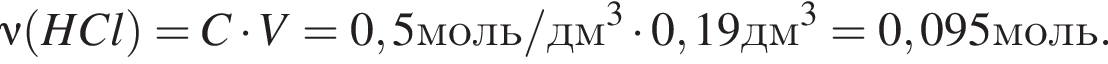

 прореагировало с
прореагировало с 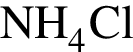 .
. Найдем массу хлорида аммония:
Найдем массу хлорида аммония: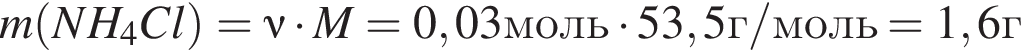

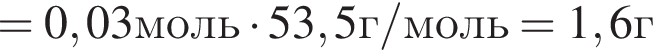
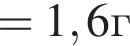
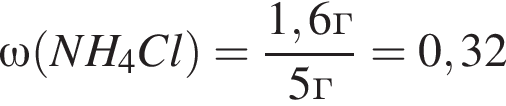 (32%)
(32%)